前交叉韧带(ACL)损伤是运动医学中最常见的致残性膝关节损伤之一,聚对苯二甲酸乙二醇酯(PET)人工韧带因标准化尺寸、无供区损伤等优势,已在全球数万例ACL重建手术中应用。但PET材料的生物惰性的问题,易引发微动诱导纤维化和异物反应,严重阻碍骨整合效率,成为制约其临床疗效的关键瓶颈。
近日,昆明理工大学灵长类转化医学研究院张磊团队联合华东理工大学刘昌胜院士团队、复旦大学华山医院运动医学科陈天午等,在智能生物材料精准修复领域取得重要进展。相关研究成果以“Friction-Adaptive Hydrogel Coating for Mechanical-Immune Synergy in Ligament-to-Bone Integration”为题发表于生物材料领域顶刊《Biomaterials》,提出一种“力学-免疫”协同调控策略,为人工韧带骨整合难题提供了创新性解决方案。

团队设计了一种摩擦自适应水凝胶涂层,破解当前PET人工韧带涂层力学稳定的难题。涂层通过π-π堆积、氢键和动态共价键与PET表面形成强黏附作用,经氧化交联后构建致密的醌基次级网络,显著提升剪切阻力和疲劳耐久性,并赋予材料自修复能力。涂层在4℃时呈流体状态,便于均匀涂覆;37℃生理温度下快速转变为稳定凝胶,实现原位固化。这种设计使涂层既能承受关节运动带来的剪切应力,又能通过自修复功能应对植入后的机械损伤,有效抑制PET表面微颗粒脱落引发的炎症。
此外,针对术后炎症失控问题,该涂层负载选择性COX-2抑制剂塞来昔布(CXB),实现时序性局部药物释放。研究发现,药物剂量对免疫调控效果至关重要:低剂量CXB(10μM)可促进M2巨噬细胞极化,诱血管形成和骨桥连接;高剂量(75μM)则会破坏免疫稳态,抑制骨整合。
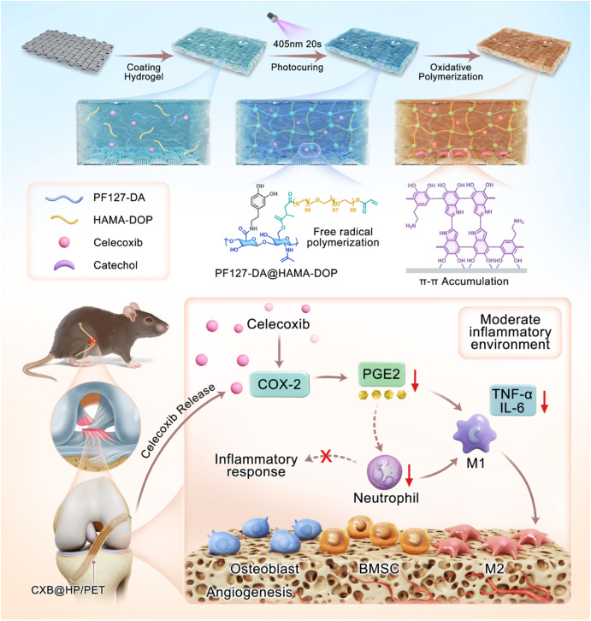
机制研究表明,低剂量CXB通过抑制COX-2/PGE2信号通路,下调TNF-α、IL-6等促炎因子表达,同时上调TGF-β1、IL-10等抗炎因子水平,构建有利于修复的免疫微环境。RNA测序结果进一步证实,低剂量组可有效抑制“免疫反应”“淋巴细胞趋化”等炎症相关通路,而高剂量组则会激活中性粒细胞趋化和急性应激反应基因集。
该研究首次将摩擦自适应力学设计与剂量依赖性免疫调控相结合,通过双网络水凝胶涂层构建“力学稳定-免疫平衡-骨整合促进”的协同效应,有效打破了PET韧带植入后的“微动-炎症”恶性循环。这种集力学适配、自修复和免疫调控材料设计,不仅为ACL重建提供了新型解决方案,也为骨科植入物表面功能化修饰提供了新思路,具有重要的临床转化价值。
(供稿:灵长类转化医学研究院)
 滇公网安备53011402000430号 All Rights Reserved © Kunming University of Science and Technology
滇公网安备53011402000430号 All Rights Reserved © Kunming University of Science and Technology