人胚外中胚层(ExM)能发育形成血岛和脐带,是胎盘绒毛(基质细胞、内皮细胞、红细胞和巨噬细胞)、羊膜和卵黄囊的重要组成部分,并分泌丰富的细胞外基质支持胚胎发育。在啮齿类中,ExM起源自卡内基分期6(Carnegie stage 6, CS6)的原肠细胞,但在包括人在内的灵长类中,ExM被特化自CS5的原肠前阶段(受精后11-12天)1。由于人胚胎研究面临伦理和技术限制,以及缺乏合适的体外模型,导致人ExM的发育起源、特化动态和信号调控机制长期处于黑匣子状态。
人胚胎干细胞(hESCs)作为胚胎上胚层(EPI)的体外对应物,不仅能够维持自我更新能力,还具有多向分化潜能,因而被视为研究EPI发育过程的理想模型。当前,hESCs主要包含两种类型,原始态(Naive)和始发态(Primed),前者在发育上对应着床前(6-7天)胚胎上胚层(Pre-EPI),后者对应着床后(13-14天)胚胎上胚层(Post-EPI)。之前的两个研究分别通过Naive和Primed hESCs,体外分化获得ExM细胞,证实hESCs具有特化为ExM的发育潜能,暗示人胚胎中,EPI可能是ExM的发育起源之一2,3。但通过hESCs分化产生ExM细胞,当前仍然存在两大难题:(1)耗时长和效率低,导致难以用其模拟和研究人ExM特化的发育动态和信号调控机制;(2)通过Naive和Primed hESCs分化产生ExM细胞的诱导体系和培养方式不同,不确定hESCs的多能状态对ExM特化是否有影响,因此不能用其回答“人EPI特化产生ExM是否具有时空特异性”这一科学问题。

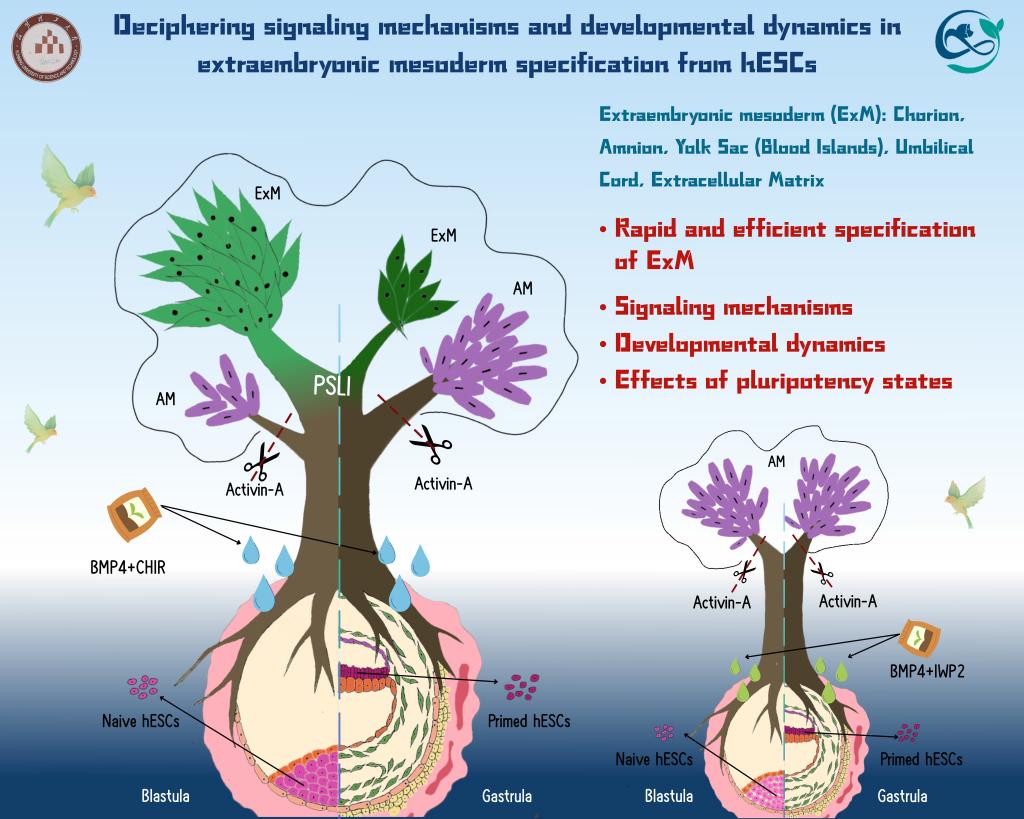
5月21日,昆明理工大学灵长类转化医学研究院季维智/李天晴/艾宗勇/尹宇团队在Nature Communications杂志上发表了题为Deciphering signaling mechanisms and developmental dynamics in extraembryonic mesoderm specification from hESCs的重要研究成果。该研究通过构建hESCs高效快速分化为ExM细胞的新体系,首次揭示:(1)人ExM发育需经历原条样细胞中间阶段;(2)在BMP活化条件下,WNT和Nodal调控人ExM特化的信号机制;(3)hESCs的多能状态对人ExM特化具有重要影响。
研究团队前期通过人胚胎和类胚胎的体外研究,发现BMP和WNT信号通路对ExM特化具有关键作用4。基于此,研究人员通过激活BMP和WNT信号建立CB培养体系,在4天内将Naive hESCs高效(>90%)分化为能够在体外长期扩增的ExM细胞。研究揭示,在BMP活化条件下,WNT信号起着命运决定开关的作用:其激活诱导ExM命运,而抑制则诱导羊膜命运。值得注意的是,该分化过程经历一个基因表达谱与原条细胞高度相似的原条样中间体(PSLI)。进一步研究发现,体外培养的原肠前人胚胎中也存在PSLI,且其出现早于ExM特化,暗示培养的人胚胎中,EPI可能也经PSLI特化为原肠前ExM。
意外的是,与Naive hESCs不同,Primed hESCs在CB条件下主要特化为羊膜而非ExM命运。为此,研究人员在CB基础上进一步激活Nodal信号建立了CBA体系,该体系能有效抑制羊膜命运,使Primed hESCs在5天内高效分化为可长期扩增的ExM细胞,且这一过程同样经历PSLI阶段。值得注意的是,CBA体系也适用于Naive hESCs,但两者存在一些差异:Naive hESCs分化过程中多能性和原条基因的下调更为缓慢,且其衍生的ExM细胞表现出造血发育潜能。比较分析显示,Naive hESCs在CB和CBA体系中产生的ExM细胞具有高度相似的基因表达谱,但与CBA体系下Primed hESCs来源的ExM细胞存在明显差异,暗示在人胚胎发育过程中,EPI衍生ExM细胞在信号响应和功能特征方面可能具有时空特异性。
综上,这项工作首次全面解析了hESCs衍生ExM细胞的信号调控机制和发育动态,并揭示了hESCs的多能状态对ExM特化的影响(包括信号响应、发育动态、细胞组成以及产生的ExM细胞的转录特征),促进了领域内对人ExM特化的理解并为后续ExM研究提供了新的模型。
昆明理工大学艾宗勇研究员、李天晴教授、尹宇副教授和季维智院士为该研究的共同通讯作者。昆明理工大学牛宝华副教授、硕士研究生王达、胡颖婕、王云笛和博士研究生施高慧为该研究的共同第一作者。该研究得到清华大学那洁副教授、昆明理工大学司晨洋副教授、康宇副教授和先进影像平台的帮助。研究受到国家重点研发计划和国家自然科学基金等项目的资助。
原文链接:
https://www.nature.com/articles/s41467-025-59491-x
1 Ross, C. & Boroviak, T. E. Origin and function of the yolk sac in primate embryogenesis. Nat Commun 11, 3760, doi:10.1038/s41467-020-17575-w (2020).
2 Pham, T. X. A. et al. Modeling human extraembryonic mesoderm cells using naive pluripotent stem cells. Cell stem cell 29, 1346-1365 e1310, doi:10.1016/j.stem.2022.08.001 (2022).
3 Wang, S. L., Shi, G. H., Duan, K., Yin, Y. & Li, T. Extraembryonic mesoderm cells derived from human embryonic stem cells rely on Wnt pathway activation. Cell Prolif, e13761, doi:10.1111/cpr.13761 (2024).
4 Ai, Z. et al. Dissecting peri-implantation development using cultured human embryos and embryo-like assembloids. Cell Res 33, 661-678, doi:10.1038/s41422-023-00846-8 (2023).
(供稿:灵长类转化医学研究院)
 滇公网安备53011402000430号 All Rights Reserved © Kunming University of Science and Technology
滇公网安备53011402000430号 All Rights Reserved © Kunming University of Science and Technology